作者:徐天添(中国科学院深圳先进技术研究院)
监制:中国科普博览
大脑是非常精密的器官,掌管着人类的思维和行动,此处发生的任何意外都可能导致人类的行动或思维受损。因此一旦大脑中出现肿瘤,外科医生往往会陷入两难:传统开颅手术需要切开层层脑组织,稍有不慎便可能导致失语、偏瘫等不可逆损伤;放疗虽能穿透颅骨,但却会无差别破坏脑细胞,无论是肿瘤还是健康脑细胞都会受损;而化疗药物又有可能被脑血屏障拦截而无法抵达肿瘤细胞处。因此如何向脑中精准投放药物消灭肿瘤细菌就成了科学家们研究的重点。
仿生设计启发:线虫如何启发我们造机器人?
深圳先进技术研究院徐天添团队近期开发出一种毫米级柔性机器人,目标是将其用于在不损伤脑组织的前提下,深入大脑精准递送药物。之所以提出这一设想,是因为大脑内部结构复杂,蛛网膜下腔的间隙不足1毫米,脑沟回纵横交错,且神经组织对外界干扰极为敏感。传统的刚性机器人易损伤脑组织,过度柔性和小型化则又带来运动能力下降等问题。
一次偶然的实验中,研究人员观察到土壤中的秀丽隐杆线虫(长度约1毫米)可以通过波浪状蠕动,穿过比自己更狭小的缝隙。这种运动模式和柔性体态,使它能在复杂地形中有效前行。受到启发,团队决定仿照线虫的结构与运动方式,通过仿生设计制造机器人。他们以患者自身血液中的纤维蛋白为基础材料,结合磁性驱动技术,研制出一种直径约1毫米、弹性模量接近脑组织的柔性机器人。该机器人具备良好的形变能力和生物相容性,可在脑脊液环境中自如运动,为穿越颅内微结构提供了新工具。

血凝胶机器人实物图
(图片来源:研究团队供图)
用患者血液制造一个机器人
任何外来材料进入大脑,都有可能被免疫系统识别为异物,引发排异反应。免疫细胞会主动聚集、包围并清除这些异物,过程可能伴随炎症,甚至损伤周围组织。这对植入性医疗设备提出了极高的生物相容性要求。传统机器人常用的金属或合成材料,很难在大脑这一高度敏感区域中长期存在而不被免疫系统排斥。
为了避免这一问题,研究团队采用患者自身血液中的纤维蛋白作为机器人主体材料。纤维蛋白是一种在伤口愈合中发挥关键作用的天然成分,具有良好的生物相容性。团队将其与磁性颗粒混合,制成柔性凝胶状材料,用于构建机器人的骨架。这种材料不仅具备柔软性,其弹性模量(约为100千帕)也接近脑组织的物理特性,有助于减小植入后的机械刺激。
在活体动物实验中,这种“血凝胶机器人”被植入猪脑后,未引起白细胞数量异常或炎症因子升高。各项免疫指标保持稳定,说明机器人能在体内长期存在而不触发明显的免疫反应。这一设计为实现安全、高效的脑部治疗奠定了基础。
依靠磁场,机器人在大脑中也活动自如
在避免了自体免疫反应之后,如何让这根柔软的血凝胶机器人在大脑复杂微环境中主动移动,便成为下一个核心课题。研究团队在机器人材料中嵌入纳米级磁性颗粒,使其能够响应外部磁场。在程序控制下,机器人可以根据磁场的变化灵活调整运动方式,以适应不同的解剖结构和行进路径。
具体来说,在外部可编程磁场的作用下,这根毫米级的纤维机器人可以以三种仿生模式灵活转换:在交变磁场下,它会像线虫一样产生纵向的波浪形摆动,形成持续的推进力;当需要依附组织表面时,纤维表面的微弱粘附力让其能抓住微小固定点,并通过自身的波浪形变完成蠕动前行;而在面对通道急转或截面突变的拐点时,机器人会切换到滚动模式,带着磁性颗粒沿着自身轴线翻滚,轻松越过障碍。这些精妙的运动机制经过3D打印的大脑沟回仿真模型和离体猪脑实验双重验证——血凝胶纤维机器人能够连续通过数级米字型挡块,抵达预设的目标位置,并且全程未对软组织造成任何机械损伤。
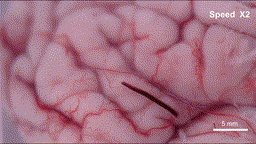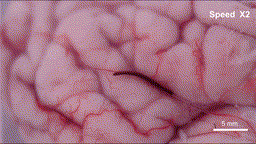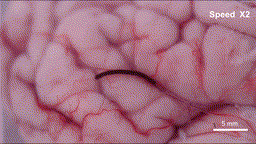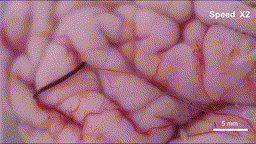
离体猪脑皮层上运动的“线虫”机器人-gif动图
(图片来源:研究团队供图)
机器人虽小,但也自带精准导航!
为了实现药物的精准递送,研究团队将机器人与X射线成像系统结合,实现实时可视化导航。在外部磁场驱动下,医生可通过成像系统监控机器人的运动轨迹,并根据路径情况动态调整磁场参数,引导其准确抵达肿瘤区域。
药物的携带与释放机制也集成在机器人本体中。实验表明,在磁场强度低于20毫特斯拉、频率低于6赫兹的条件下,机器人结构保持稳定,药物不会提前释放;一旦抵达目标区域,通过提高磁场强度和频率(约50毫特斯拉、24赫兹),机器人会迅速碎解为微米级颗粒,将所载药物(如阿霉素)局部释放到肿瘤组织内。
这种控制方式实现了空间和时间上的精准释放,减少了药物对正常脑组织的影响。研究人员在18头小型猪的脑胶质瘤模型上分组开展验证,结果显示机器人治疗组的肿瘤体积只有对照组的四分之一左右,而活体猪的血液细胞计数和多项生化指标依旧保持在正常水平,未见炎症反应或器官功能损伤。更难能可贵的是,机器人执行完任务后可在体内逐步分解,无需再次取出手术,这一特性将为患者带来更少的身体负担与心理压力。
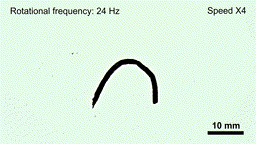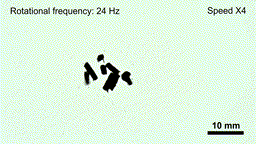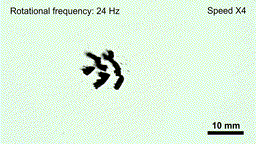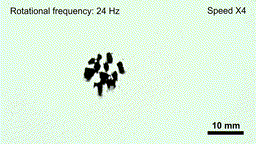
在高频交变磁场下“线虫”机器人碎片化,释放内部药物(gif动图)
(图片来源:研究团队供图)
线虫机器人研究意义:从实验室突破到临床曙光
当前,研究团队的“线虫机器人”已在活体大型动物实验中展现出巨大潜力,在活体动物实验中,这种毫米级机器人将肿瘤区域的药物浓度提高至传统静脉注射的十倍以上,为突破血脑屏障提供了新方法。前文提到的实验结果也显示其具备良好的疗效和安全性,为后续临床转化提供了初步依据。
尽管距离临床应用还需攻克长期生物安全性验证、量产标准化等难关,但其意义已远超技术本身。未来若实现转化,患者或仅需通过微创注射接受治疗,告别开颅手术的创伤与感染风险,治疗周期实现大幅度缩短。对于深部肿瘤患者,这种“打针送药,磁场驱动,X射线导航”的治疗模式,将彻底改写传统治疗手段,让精准医疗真正穿透血脑屏障。
“这不仅是送药工具的升级,更是治疗逻辑的颠覆。”徐天添表示,“当机器人能像‘自体细胞’一样在脑中自由穿行时,人类对抗脑疾病的战场,将从‘伤敌一千自损八百’的阵地战,转向‘精准狙杀’的智能战。”
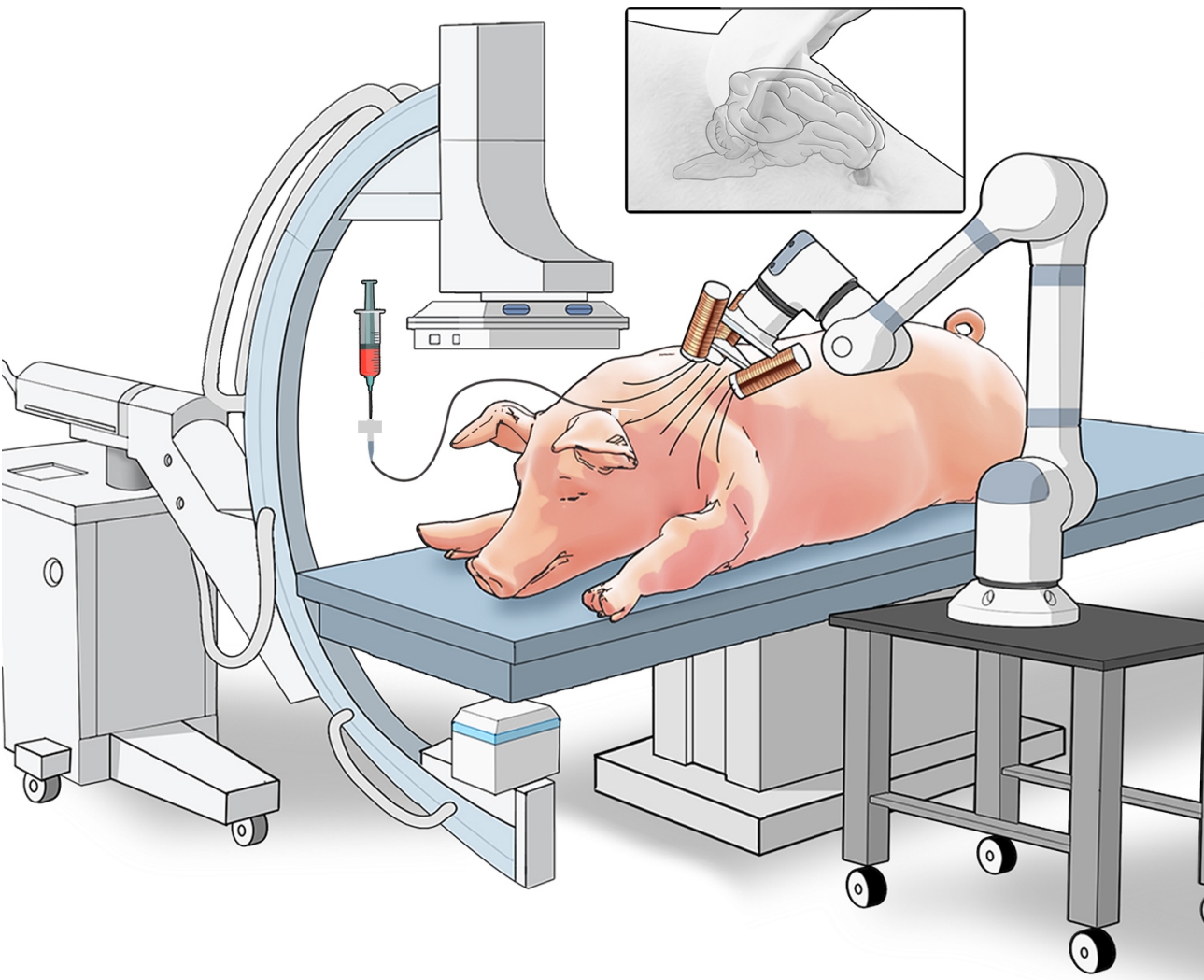
活体猪体内实验验证
(图片来源:研究团队供图)
研究团队正在进一步优化线虫机器人的材料和结构性能。一方面,他们尝试引入响应性更高的磁性材料,以提升机器人在复杂脑环境中的运动精度和控制能力。另一方面,团队也在探索将光学成像和超声成像等多种导航手段结合,实现更高分辨率的实时定位。
在基础研究方面,团队关注机器人与脑组织界面的流体力学特性,希望通过微流控设计减少对微环境的扰动,并提高药物释放的效率。同时,他们也计划测试机器人在携带不同类型药物或基因载体时的释放行为,以推动个性化治疗的发展。
未来,该技术也有望扩展至脑部以外的复杂部位,例如脊髓损伤修复或心血管系统的微创干预。通过不断改进材料、驱动和导航策略,研究人员希望将这类柔性机器人发展为医学微创治疗中的通用平台。


